电离平衡--电离平衡教案
发布时间:2014-11-01 编辑:教案中心小组 来源:网络&投稿
第二课时 电离平衡
教学目标
知识目标:
1.掌握弱电解质的电离平衡。
2.了解电离平衡常数的概念。
3.了解影响电离平衡的因素
能力目标:
1.培养学生阅读理解能力。
2.培养学生分析推理能力。
情感目标:
由电解质在水分子作用下,能电离出阴阳离子,体会大千世界阴阳共存,相互对立统一,彼此依赖的和谐美。
教学过程
今天学习的内容是:“电离平衡”知识。
1.弱电解质电离过程(用图像分析建立)
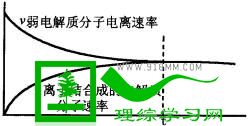
2.当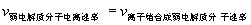
则弱电解质电离处于平衡状态,叫“电离平衡”,此时溶液中的电解质分子数、离子数保持恒定,各自浓度保持恒定。
3.与化学平衡比较
(1)电离平衡是动态平衡:即弱电解质分子电离成离子过程和离子结合成弱电解质分子过程仍在进行,只是其速率相等。
(2)此平衡也是有条件的平衡:当条件改变,平衡被破坏,在新的条件下建立新的平衡,即平衡发生移动。
(3)影响电离平衡的因素
A.内因的主导因素。
B.外因有:
①温度:电离过程是一个吸热过程,所以,升高温度,平衡向电离方向移动。
②浓度:
问题讨论:在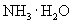

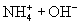 的平衡体系中:
的平衡体系中:
①加入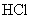 :
:
②加入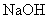 :
:
③加入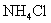 :各离子分子浓度如何变化:
:各离子分子浓度如何变化: 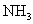 、
、 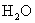 、
、  、
、 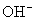 溶液
溶液 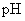 如何变化?(“变高”,“变低”,“不变”)
如何变化?(“变高”,“变低”,“不变”)
(4)电离平衡常数
(ⅱ)一元弱酸:
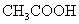

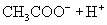
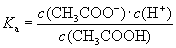
(3)一元弱碱
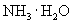

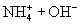
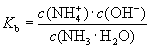
①电离平衡常数化是温度函数,温度不变K不变。
②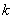 值越大,该弱电解质较易电离,其对应的弱酸弱碱较强;
值越大,该弱电解质较易电离,其对应的弱酸弱碱较强; 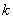 值越小,该弱电解质越难电离,其对应的弱酸弱碱越弱;即
值越小,该弱电解质越难电离,其对应的弱酸弱碱越弱;即 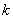 值大小可判断弱电解质相对强弱。
值大小可判断弱电解质相对强弱。
③多元弱酸是分步电离的,一级电离程度较大,产生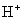 ,对二级、三级电离产生抑制作用。如:
,对二级、三级电离产生抑制作用。如:
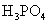

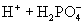
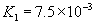
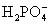

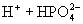
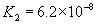
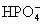

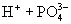
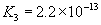
随堂练习
1.足量镁和一定量的盐酸反应,为减慢反应速率,但又不影响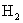 的总量,可向盐酸中加入下列物质中的( )
的总量,可向盐酸中加入下列物质中的( )
A. B.
B.  C.
C. 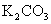 D.
D. 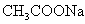
2.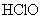 是比碳酸还要弱的酸,为了提高氯水中
是比碳酸还要弱的酸,为了提高氯水中 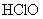 的浓度,可加入( )
的浓度,可加入( )
A.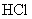 B.
B. 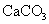 C.
C. 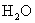 D.
D. 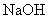
3.浓度和体积都相同的盐酸和醋酸,在相同条件下分别与足量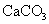 固体(颗粒大小均相同)反应,下列说法中正确的是( )
固体(颗粒大小均相同)反应,下列说法中正确的是( )
A.盐酸的反应速率大于醋酸的反应速率
B.盐酸的反应速率等于醋酸的反应速率
C.盐酸产生的二氧化碳比醋酸
D.盐酸和醋酸产生的二氧化碳一样多
4.下列叙述中可说明酸甲比酸乙的酸性强的是( )
A.溶液导电性酸甲大于酸乙
B.钠盐溶液的碱性在相同物质的量浓度时,酸甲的钠盐比酸乙的钠盐弱
C.酸甲中非金属元素比酸乙中非金属元素化合价高
D.酸甲能与酸乙的铵盐反应有酸乙生成
5.有两种一元弱酸的钠盐溶液,其物质的量浓度相等,现将这两种盐的溶液中分别通入适量的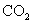 ,发生如下反应:
,发生如下反应:
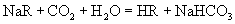
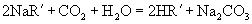
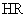 和
和 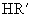 的酸性强弱比较,正确的是( )
的酸性强弱比较,正确的是( )
A.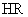 较弱 B.
较弱 B. 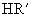 较弱 C.两者相同 D.无法比较
较弱 C.两者相同 D.无法比较
总结、扩展
1.化学平衡知识与电离平衡知识对照比较。
2.一元弱酸弱碱中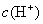 与
与 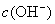 的求法:
的求法:
弱电酸中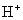 浓度:
浓度: 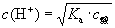 (酸为弱酸物质的量浓度)
(酸为弱酸物质的量浓度)
弱碱中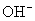 浓度:
浓度: 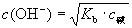 (碱为弱碱物质的量浓度)
(碱为弱碱物质的量浓度)
3.讨论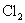 中存在哪些微粒?(包括溶剂)
中存在哪些微粒?(包括溶剂)
4.扩展
难溶电解质在水溶液中存在着电离平衡。在常温下,溶液中各离子浓度以它们的系数为方次的乘积是一个常数,该常数叫溶度各(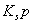 )。例如
)。例如
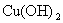

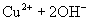

溶液中各离子浓度(加上其方次)的乘积大于、等于溶度积时出现沉淀,反之沉淀溶解。
(1)某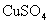 溶液中
溶液中 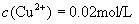 ,如需生成
,如需生成 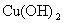 沉淀,应调整溶液的
沉淀,应调整溶液的 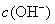 使之大于 。
使之大于 。
(2)要使0.2mol/L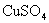 溶液中的
溶液中的 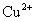 沉淀较为完全(使
沉淀较为完全(使 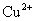 浓度降低至原来的千分之一),则应向溶液里加入
浓度降低至原来的千分之一),则应向溶液里加入 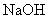 溶液,使溶液
溶液,使溶液 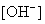 为 。
为 。
布置作业
第二课时
P60一、填空题:2.3.4.
P61四、
板书设计
第二课时
一、电解质,非电解质
1.定义:在水溶液中或熔融状态下,能导电的化合物叫电解质。
[思考]①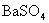 ,
, 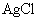 在水溶液中,不导电,它属于非电解质吗?为什么?
在水溶液中,不导电,它属于非电解质吗?为什么?
②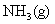 溶于水能导电,则氨气是电解质吗?为什么?
溶于水能导电,则氨气是电解质吗?为什么?
③共价化合物在液态时,能否导电?为什么?
2.电解质导电实质,电解质溶液导电能力强弱的原因是什么?
二、强电解质,弱电解质
1.区分电解质强弱的依据:
电解质在溶液中“电离能力”的大小。

2.电离方程式:
电离方程式书写也不同
(1)强电解质: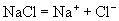
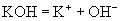
(2)弱电解质: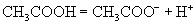
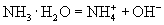
3.强弱电解质与结构关系。
(1)强电解质结构:强碱,盐等离子化合物(低价金属氧化物);
强酸,极性共价化合物;
(2)弱电解质结构:弱酸,弱碱具有极性共价位的共价化合物。
三、弱电解质电离平衡
1.电离平衡定义
在一定条件下(如温度,浓度),当电解质分子电离成离子的速率和离子重新结合成分子的速度相等时,电离过程就达到了平衡状态,这叫做电离平衡。
2.电离平衡与化学平衡比较
“等”:电离速率与离子结合成分子的速率相等。
“定”:离子、分子的浓度保持一定。
“动”:电离过程与离子结合成分子过程始终在进行。
“变”:温度、浓度等条件变化,平衡就被破坏,在新的条件下,建立新的平衡。
3.影响电离平衡的外界因素
(1)温度:温度升高,电离平衡向右移动,电离程度增大。
温度降低,电离平衡向左移动,电离程度减小。
(2)浓度:电解质溶液浓度越大,平衡向右移动,电离程度减小;
电解质溶液浓度越小,平衡向左移动,电离程度增大;
4.电离平衡常数
(1)一元弱酸电离平衡常数:
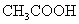

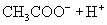
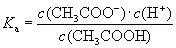
(2)一元弱碱电离平衡常数: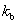
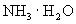

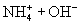
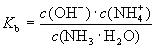
(3)多元弱酸是分步电离,每步各有电离常数。如: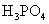
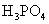

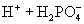
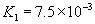
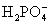

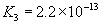
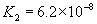
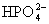

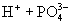
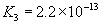
(4)电离平衡常数只随温度变化而变化,而与浓度无关。
(5)K的意义:
K值越大,弱电解质较易电离,其对应弱酸、弱碱较强。
K值越小,弱电解质较难电离,其对应弱酸、弱碱较弱。
教学目标
知识目标:
1.掌握弱电解质的电离平衡。
2.了解电离平衡常数的概念。
3.了解影响电离平衡的因素
能力目标:
1.培养学生阅读理解能力。
2.培养学生分析推理能力。
情感目标:
由电解质在水分子作用下,能电离出阴阳离子,体会大千世界阴阳共存,相互对立统一,彼此依赖的和谐美。
教学过程
今天学习的内容是:“电离平衡”知识。
1.弱电解质电离过程(用图像分析建立)

2.当
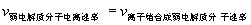
则弱电解质电离处于平衡状态,叫“电离平衡”,此时溶液中的电解质分子数、离子数保持恒定,各自浓度保持恒定。
3.与化学平衡比较
(1)电离平衡是动态平衡:即弱电解质分子电离成离子过程和离子结合成弱电解质分子过程仍在进行,只是其速率相等。
(2)此平衡也是有条件的平衡:当条件改变,平衡被破坏,在新的条件下建立新的平衡,即平衡发生移动。
(3)影响电离平衡的因素
A.内因的主导因素。
B.外因有:
①温度:电离过程是一个吸热过程,所以,升高温度,平衡向电离方向移动。
②浓度:
问题讨论:在
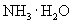

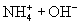 的平衡体系中:
的平衡体系中:①加入
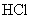 :
:②加入
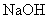 :
:③加入
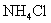 :各离子分子浓度如何变化:
:各离子分子浓度如何变化: 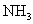 、
、 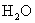 、
、  、
、 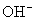 溶液
溶液 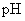 如何变化?(“变高”,“变低”,“不变”)
如何变化?(“变高”,“变低”,“不变”)(4)电离平衡常数
(ⅱ)一元弱酸:
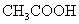

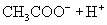
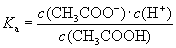
(3)一元弱碱
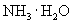

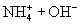
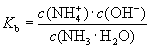
①电离平衡常数化是温度函数,温度不变K不变。
②
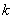 值越大,该弱电解质较易电离,其对应的弱酸弱碱较强;
值越大,该弱电解质较易电离,其对应的弱酸弱碱较强; 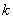 值越小,该弱电解质越难电离,其对应的弱酸弱碱越弱;即
值越小,该弱电解质越难电离,其对应的弱酸弱碱越弱;即 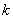 值大小可判断弱电解质相对强弱。
值大小可判断弱电解质相对强弱。③多元弱酸是分步电离的,一级电离程度较大,产生
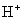 ,对二级、三级电离产生抑制作用。如:
,对二级、三级电离产生抑制作用。如: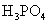

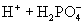
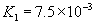
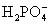

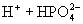
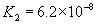
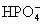

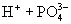
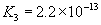
随堂练习
1.足量镁和一定量的盐酸反应,为减慢反应速率,但又不影响
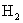 的总量,可向盐酸中加入下列物质中的( )
的总量,可向盐酸中加入下列物质中的( )A.
 B.
B. 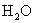 C.
C. 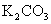 D.
D. 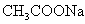
2.
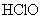 是比碳酸还要弱的酸,为了提高氯水中
是比碳酸还要弱的酸,为了提高氯水中 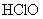 的浓度,可加入( )
的浓度,可加入( )A.
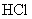 B.
B. 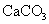 C.
C. 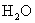 D.
D. 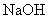
3.浓度和体积都相同的盐酸和醋酸,在相同条件下分别与足量
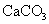 固体(颗粒大小均相同)反应,下列说法中正确的是( )
固体(颗粒大小均相同)反应,下列说法中正确的是( )A.盐酸的反应速率大于醋酸的反应速率
B.盐酸的反应速率等于醋酸的反应速率
C.盐酸产生的二氧化碳比醋酸
D.盐酸和醋酸产生的二氧化碳一样多
4.下列叙述中可说明酸甲比酸乙的酸性强的是( )
A.溶液导电性酸甲大于酸乙
B.钠盐溶液的碱性在相同物质的量浓度时,酸甲的钠盐比酸乙的钠盐弱
C.酸甲中非金属元素比酸乙中非金属元素化合价高
D.酸甲能与酸乙的铵盐反应有酸乙生成
5.有两种一元弱酸的钠盐溶液,其物质的量浓度相等,现将这两种盐的溶液中分别通入适量的
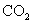 ,发生如下反应:
,发生如下反应: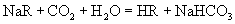
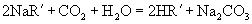
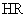 和
和 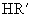 的酸性强弱比较,正确的是( )
的酸性强弱比较,正确的是( )A.
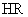 较弱 B.
较弱 B. 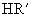 较弱 C.两者相同 D.无法比较
较弱 C.两者相同 D.无法比较总结、扩展
1.化学平衡知识与电离平衡知识对照比较。
2.一元弱酸弱碱中
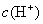 与
与 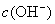 的求法:
的求法:弱电酸中
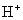 浓度:
浓度: 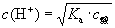 (酸为弱酸物质的量浓度)
(酸为弱酸物质的量浓度)弱碱中
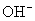 浓度:
浓度: 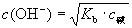 (碱为弱碱物质的量浓度)
(碱为弱碱物质的量浓度)3.讨论
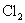 中存在哪些微粒?(包括溶剂)
中存在哪些微粒?(包括溶剂)4.扩展
难溶电解质在水溶液中存在着电离平衡。在常温下,溶液中各离子浓度以它们的系数为方次的乘积是一个常数,该常数叫溶度各(
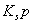 )。例如
)。例如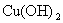

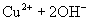

溶液中各离子浓度(加上其方次)的乘积大于、等于溶度积时出现沉淀,反之沉淀溶解。
(1)某
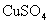 溶液中
溶液中 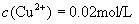 ,如需生成
,如需生成 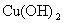 沉淀,应调整溶液的
沉淀,应调整溶液的 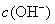 使之大于 。
使之大于 。(2)要使0.2mol/L
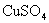 溶液中的
溶液中的 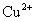 沉淀较为完全(使
沉淀较为完全(使 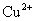 浓度降低至原来的千分之一),则应向溶液里加入
浓度降低至原来的千分之一),则应向溶液里加入 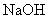 溶液,使溶液
溶液,使溶液 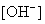 为 。
为 。布置作业
第二课时
P60一、填空题:2.3.4.
P61四、
板书设计
第二课时
一、电解质,非电解质
1.定义:在水溶液中或熔融状态下,能导电的化合物叫电解质。
[思考]①
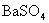 ,
, 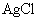 在水溶液中,不导电,它属于非电解质吗?为什么?
在水溶液中,不导电,它属于非电解质吗?为什么?②
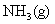 溶于水能导电,则氨气是电解质吗?为什么?
溶于水能导电,则氨气是电解质吗?为什么?③共价化合物在液态时,能否导电?为什么?
2.电解质导电实质,电解质溶液导电能力强弱的原因是什么?
二、强电解质,弱电解质
1.区分电解质强弱的依据:
电解质在溶液中“电离能力”的大小。

2.电离方程式:
电离方程式书写也不同
(1)强电解质:
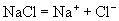
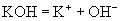
(2)弱电解质:
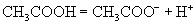
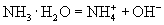
3.强弱电解质与结构关系。
(1)强电解质结构:强碱,盐等离子化合物(低价金属氧化物);
强酸,极性共价化合物;
(2)弱电解质结构:弱酸,弱碱具有极性共价位的共价化合物。
三、弱电解质电离平衡
1.电离平衡定义
在一定条件下(如温度,浓度),当电解质分子电离成离子的速率和离子重新结合成分子的速度相等时,电离过程就达到了平衡状态,这叫做电离平衡。
2.电离平衡与化学平衡比较
“等”:电离速率与离子结合成分子的速率相等。
“定”:离子、分子的浓度保持一定。
“动”:电离过程与离子结合成分子过程始终在进行。
“变”:温度、浓度等条件变化,平衡就被破坏,在新的条件下,建立新的平衡。
3.影响电离平衡的外界因素
(1)温度:温度升高,电离平衡向右移动,电离程度增大。
温度降低,电离平衡向左移动,电离程度减小。
(2)浓度:电解质溶液浓度越大,平衡向右移动,电离程度减小;
电解质溶液浓度越小,平衡向左移动,电离程度增大;
4.电离平衡常数
(1)一元弱酸电离平衡常数:

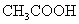

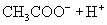
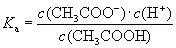
(2)一元弱碱电离平衡常数:
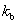
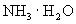

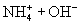
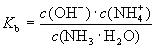
(3)多元弱酸是分步电离,每步各有电离常数。如:
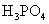
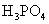

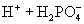
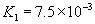
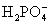

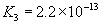
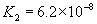
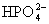

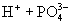
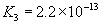
(4)电离平衡常数只随温度变化而变化,而与浓度无关。
(5)K的意义:
K值越大,弱电解质较易电离,其对应弱酸、弱碱较强。
K值越小,弱电解质较难电离,其对应弱酸、弱碱较弱。
